LA PHOSPHORYLATION OXYDATIVE
Dans cette vidéo, nous sommes dans le contexte de la phosphorylation oxydative se déroulant dans les mitochondries. Elle produit l’essentiel de l’ATP nécessaire aux cellules ayant un métabolisme aérobie. Cette synthèse est conjointe des réactions du cycle de Krebs, qui ont lieu dans la matrice mitochondriale, et de celles de la phosphorylation oxydative, qui ont lieu au niveau de la membrane interne mitochondriale.
La phosphorylation oxydative dépend d’un transfert d’électrons. La synthèse d’ATP est couplée au flux des électrons venant du NADH,H+ et/ou du FADH2 allant vers l’accepteur finale: le dioxygène grâce au gradient de protons présent de part et d’autre de la membrane interne. Le flux des électrons se traduit par le pompage de protons hors de la matrice au niveau de 3 complexes, cela engendre un potentiel de membrane important.
L’ATP est synthétisé lorsque les protons reviennent vers la matrice en empruntant un canal présent au niveau de l’ATP synthase.
-Objectifs:
- Savoir schématiser la manière dont le gradient de protons connecte transport d’électrons et synthèse d’ATP.
- Savoir expliquer le mode de conversion énergétique assurant la phosphorylation de l’ADP en ATP au cours de la phosphorylation oxydative.
- Connaître les caractéristiques de l’ATP synthase et les relier à la conversion d’énergie osmo-chimique.
-Terminale S
-Connaitre les grandes bases en bioénergétique, la notion de couplage énergétique
-Vidéos à avoir vu sur le site: Le cycle de Krebs-La glycolyse
MODULE: METABOLISME CELLULAIRE
CHAPITRE 2: Métabolisme glucidique
Cours: La chaîne respiratoire
LES QUESTIONS POSÉES / LES RÉPONSES ASSOCIÉES
(n’hésitez pas à commenter afin d’améliorer les réponses si besoin !)
Q1: Pourquoi le gradient de proton n’est-il pas dissipé par les porines de la membrane externe ?
R1: Alors, mini rappel : la membrane interne est très imperméable à tout un tas de molécules (les petites, mais aussi les ions… je préparerais une vidéo sur tous ces aspects là bientôt). On note la présence dans cette membrane d’un lipide très particulier, appeler cardiolipide (structure très particulière qui rend la membrane très imperméable aux H+. Il existe ainsi une différence de composition entre ce compartiment et celui de la matrice. Mais en plus, il existe une différence de potentiel électrique, que l’on estime entre -160 et -230 mV selon les livres. Je vous ai mis -230 mV dans la vidéo.
L’accumulation de protons dans l’espace intermembranaire induit une différence de pH, c’est la composante chimique du gradient, mais qui reste faible du fait de la dilution des protons vers le cytosol ! Certains, mais pas tous, sortent de l’espace intermembranaire.
La membrane externe est perméable aux H+, grâce à ces porines comme tu le rappelles dans ta question
On n’a pas 100% des H+ qui passent par l’ATP synthase, certains quittent l’espace intermembranaire pour le cytosol.
Du fait que l’accumulation de protons induisent une différence de potentiel au niveau de la membrane interne (négative vers la matrice), ce gradient électrochimique favorise la diffusion des H+ dans le sens de leur gradient –> de l‘espace intermembranaire vers la matrice en passant par l’ATP synthase. C’est un flux spontané.
Q2: Il y a une erreur au début de la vidéo je crois, il me semble qu’on a réduction de seulement 6 et non 8 NADH,H+ suite au Krebs à partir d’un glucose. Je fais peut être erreur mais à vérifier…
R2: En fait, si tu prends le cycle strictement, tu as raison, il y a bien 2 X 3 NADH,H+ donc –> 6 comme tu dis, mais ici, j’ai intégré le NADH,H+ de la réaction pyruvate –> acétyl-CoA qui réduit un NAD+ supplémentaire. D’ou les 8 NADH,H+ .
Q3: Concernant le nombre de proton éjecté en dehors de la matrice mitochondirale il y a bien une raison à ce chiffre non ? Pour moi c’est un peu flou, mais d’après ce que j’ai pu lire j’en ai conclu la chose suivante : à chaque fois que l’on passe part un intermédiraire de complexe (par exemple Fe-S du complexe 1) on a transfert d’un proton H+ et d’un e- formant sur ce complexe un atome d’hydrogène complet et au moment de l’oxydation de ce complexe un proton H+ est éjecté en dehors de la membrane, l’e- lui est tranféré sur une molécule qui devient réduite, cet éléctron est couplé avec un nouveau proton h+.
Bref pouvez m’éclaires un peu sur ce mécanisme s’il vous plait ? De plus, jai du ma à comprendre le H+ que l’on met à chaque fois à côté du NADH,H+ <— (est-ce ce proton couplé à un électron qui sert à former un H complet pour réduire une molécule ?)
R3: Bonsoir, alors déjà, le transfert d’électrons amène les complexes I, III et IV à transporter des protons à travers la membrane interne mitochondriale depuis la matrice à l’espace intermembranaire.
Dans les ouvrages généralistes de biochimie, la réponse posée n’est pas traité… par contre, dans un livre plus spécialisé, comme le Biochimie de VOET, des éléments détaillés s’y trouvent.
Déjà 2 mécanismes de transport de protons ont été proposés:
-Mécanisme des boucles d’oxydo-réduction
-Mécanisme de pompe à protons.
Pour le 1° mécanisme, tout est détaillé page 821, 822 & 823. C’est assez poussé. Ci dessous un petit schéma général de ce qu’il se passerait (conditionnel !) dans ce mécanisme, attention cela ne concernerait pas les 3 complexes… selon la présence de FMN, CoQ … ce serait pas les mêmes mécanismes.
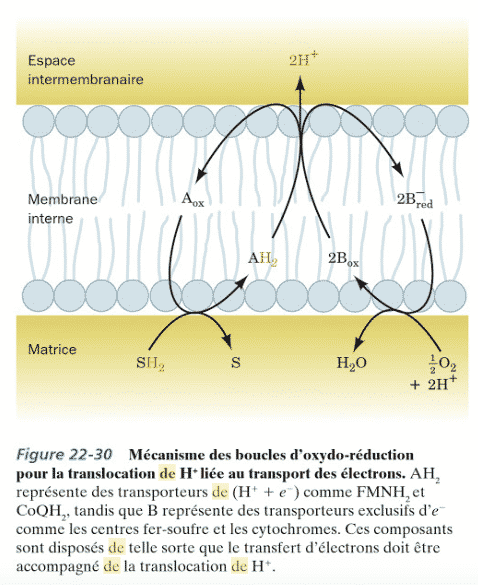
Ce schéma présente la translocation des électrons au sein de la membre interne mitochondriale.
Pour le 2° mécanisme, cela ne concernerait que le complexe 4, car il ne contient pas de transporteur (H+ + e-) et ne peut fonctionner selon une boucle d’oxydoréduction. Il s’agirait ici d’un mécanisme de type: voir figure ci dessous:
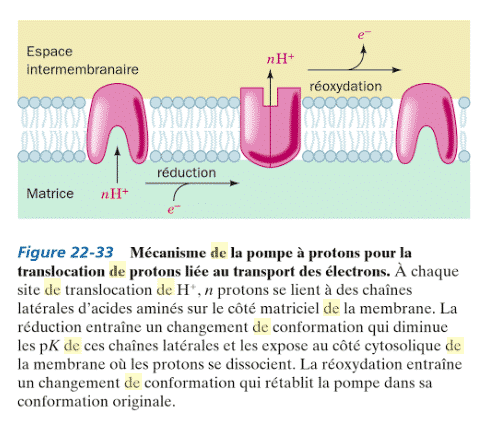
Ce schéma présente comment se réalise le transport d’électrons, le mécanisme.
Ici, selon ce modèle, le transfert d’électrons entraîne des changements de conformation du complexe. La translocation unidirectionnelle de protons est le résultat de l’influence de ces changements de conformation sur les valeurs de pK de chaînes latérales d’acides aminés et de leur exposition, en alternance, d’un côté ou de l’autre de la membrane interne mitochondriale.
Plus de détail, dans ce même ouvrage p. 824, 825.
Voilà, dans toute bibliothèque universitaire, tu peux avoir accès GRATUITEMENT à cet ouvrage, va directement au niveau de ces pages.
J’espère que cela répondra complètement à ta question. à bientôt !
Q4 (Sarah H.): Bonsoir, le complexe 4 est une pompe a 4 protons non ?
R4: Dans les ouvrages, au niveau de ce complexe on peut voir une flèche avec 2 H+ passant dans l’espace intermembranaire … MAIS pour la réaction permettant la formation d’UNE molécule d’eau.
Or, dans les bilans résumé de ce complexe, il est écrit qu’il passe 4 H+ (comme tu le dis), pour DEUX molécules d’eau
Donc, dans l’animation que je vous ai faite, 2H+ pour UNE molécule d’eau, soit 4H+ pour DEUX molécules d’eau
J’espère que ça te va ? N’hésite pas à me l’indiquer. à bientôt !
Q5 (J-B. Bruneau.): Mon prof de biochimie affirme que ce n’est pas 2H+ qui sont transportés dans l’espace inter-membranaire par le complexe 3 mais 4H+.
R5: Selon les ouvrages, les réponses diffèrent. Voici quelques exemples:
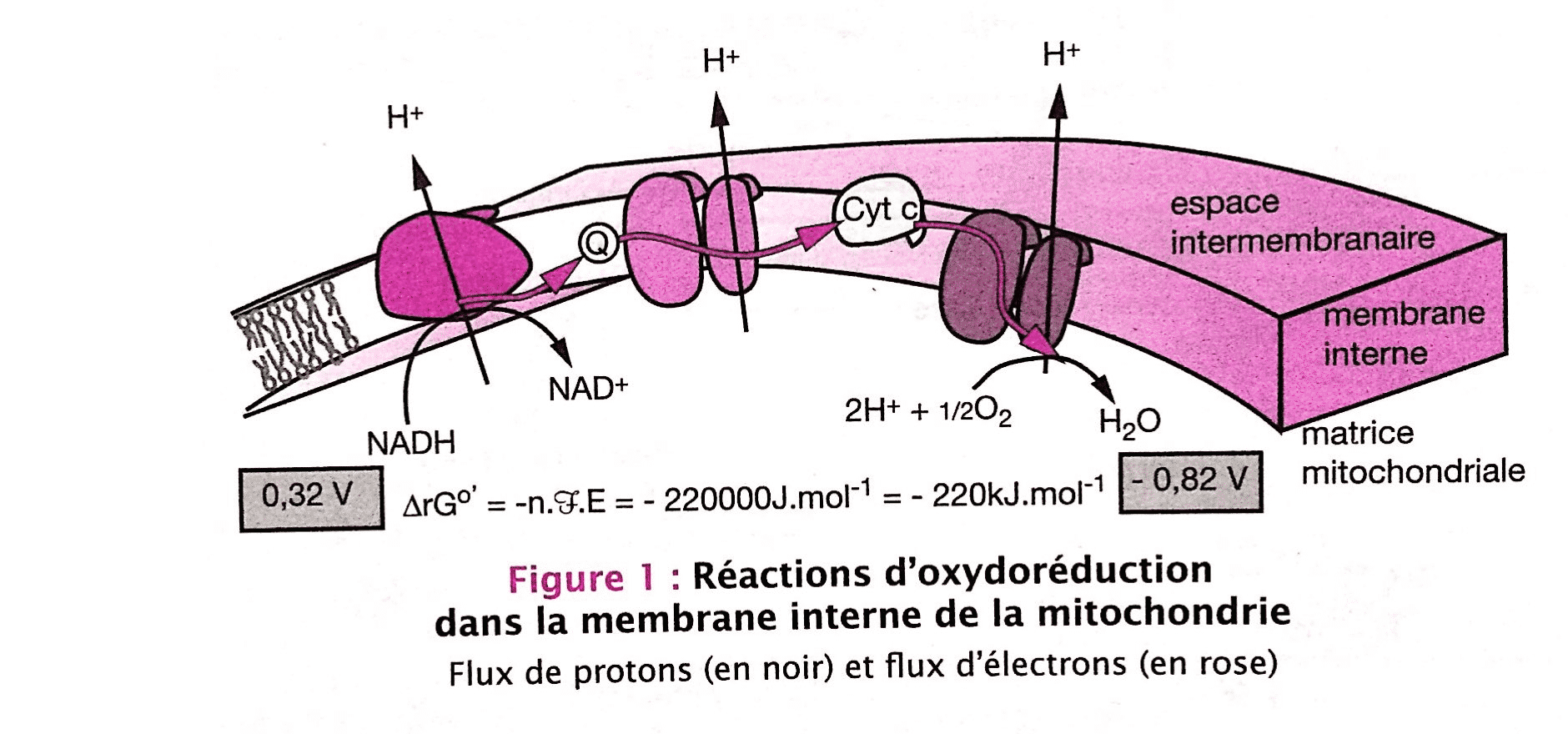
Schéma de la chaine respiratoire
Ce 1° schéma, issu de l’ouvrage Biologie cellulaire et moléculaire, tout le cours en fiche de D. Boujard, Anselme, Cullin, Raguénès-Nicol, montre de manière synthétique les flux de protons, sans chiffre… Pas évident, car pas de détails, mais ce n’est pas le but ici.
Puis dans l’ouvrage : L. Stryer (7° édition), page 535,
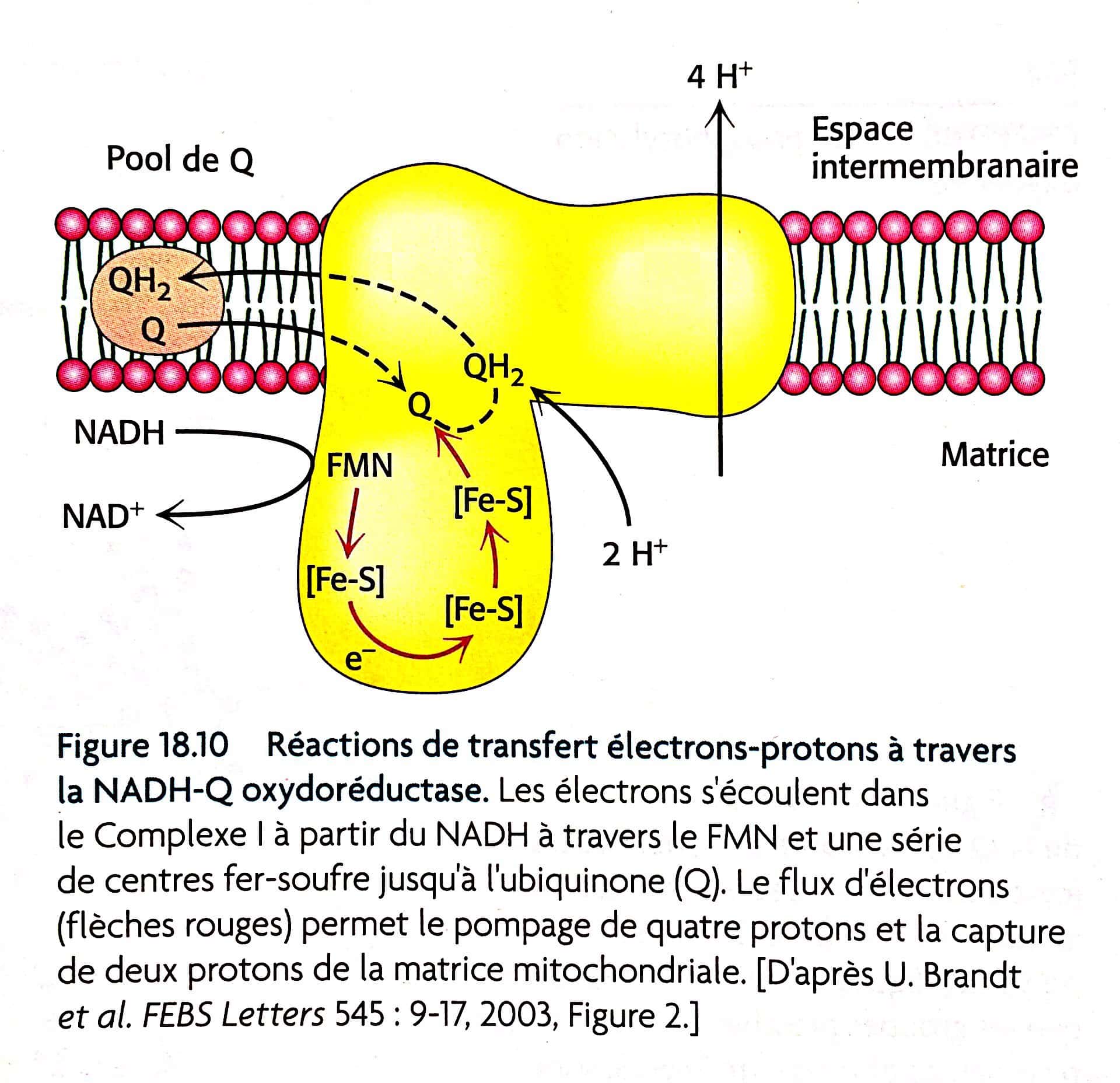
on peut distinguer plus de détails, beaucoup plus même… Ici, la flèche nous indique que 4H+ passent par ce complexe III. Mais la relation avec le QH2 n’y est pas.
Une page plus loin, nous avons une figure expliquant le cycle Q:
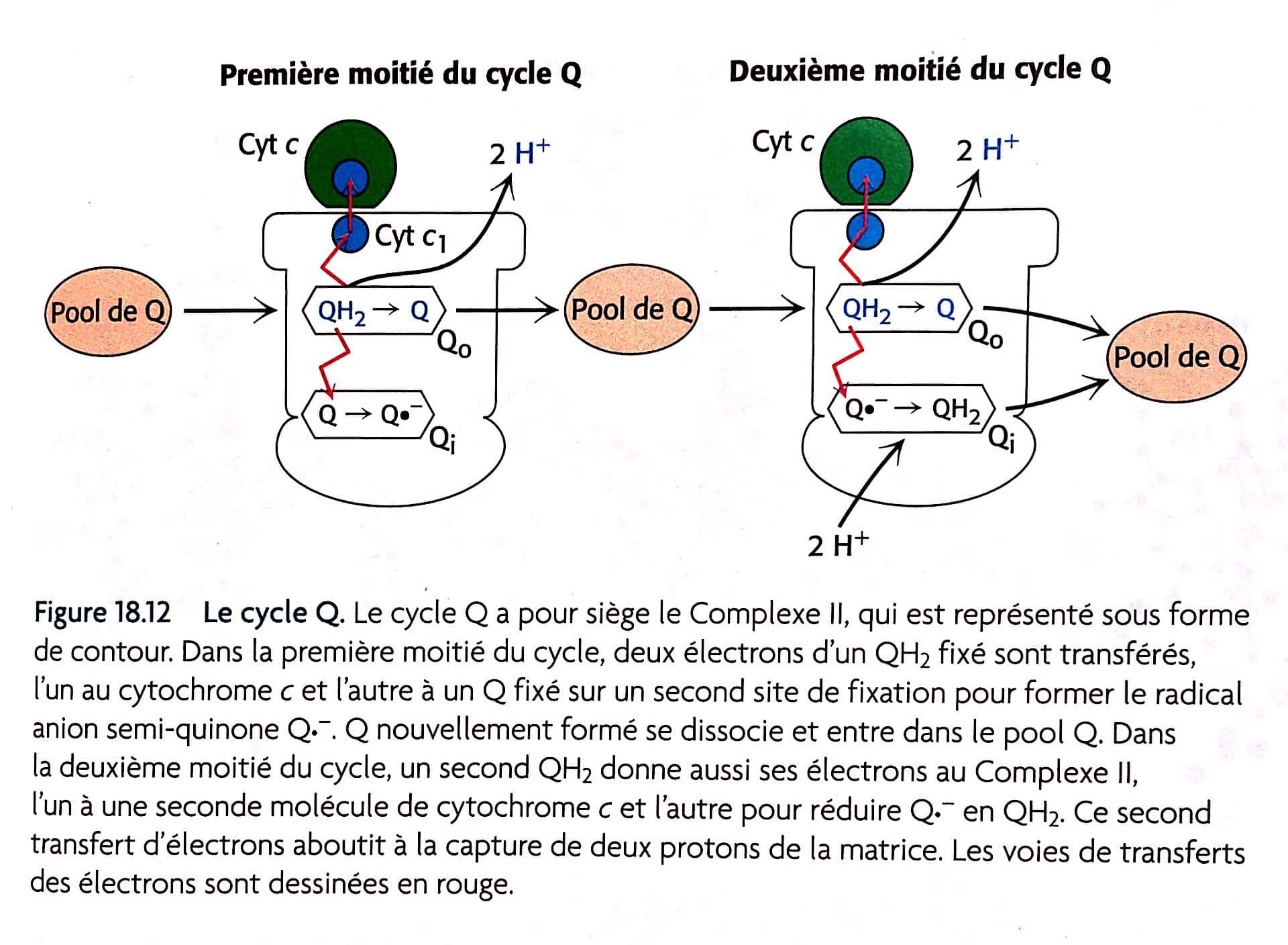
Nous comprenons maintenant pourquoi 4 H+, car 2 molécules QH2 sont oxydées pour former 2 molécules Q, et puis une molécule Q est réduite en QH2. Au total, 4 protons sont libérés dans l’espace intermembranaire et 2 protons sont retirés de la matrice mitochondriale. (Pour aller plus loin, voir page 537).
Donc, merci Jean-Baptiste pour ta question, ceci à permis d’aller plus loin et rectifier mes propos trop simplistes, voir faux avec ce chiffre.

