LE CONTRÔLE DE LA GLYCOLYSE
La glycolyse, voie métabolique anaérobie se déroulant dans le cytosol comporte en 10 étapes. Cette voie a un double rôle: dégrader le glucose pemettant de produire de l’ATP et d’apporter des éléments pour la synthèse de constituants cellulaires. La vitesse de conversion du glucose en pyruvate est régulée/contrôlée afin de ‘satisfaire’ ces 2 besoins cellulaires majeurs.
Les réactions de la glycolyse sont facilement réversibles à l’exception des réactions 1, 3 et 10. Dans cette vidéo, vous y découvrirez tous les détails concernant ces 3 points clés majeurs.
-Terminale S
-Connaitre les grandes bases en bioénergétique / les bases en enzymologie
-Vidéo à avoir vu: La glycolyse
MODULE: METABOLISME CELLULAIRE
CHAPITRE 2: Métabolisme glucidique
Cours: Le contrôle de la glycolyse
LES QUESTIONS POSÉES / LES RÉPONSES ASSOCIÉES:
(n’hésitez pas à commenter afin d’améliorer les réponses si besoin !)
Q1 (de Claire): Bonjour ! J’ai une petite remarque lorsque tu parles du rétrocontrôle de l’hexokinase par le G6P. Peut-on vraiment qualifier le G6P d’inhibiteur « allostérique » ? Parce que l’hexokinase étant une enzyme michaelienne, ça me parait bizarre. Il me semble que ce terme est justement réservé aux enzymes allostériques.
R1: Bonjour Claire, déjà merci pour la question, et c’est bien que tu la poses ici :). Déjà, l’hexokinase est une enzyme monomérique, et elle figure comme exemple à détailler dans les nouveaux programmes de BCPST. On a souvent tendance à dire que seules les enzymes oligomériques possèdent des effecteurs allostériques. Mais ce n’est pas vraiment le cas…
D’autre part, une autre notion, celle de coopération, ou coopérativité, est aussi à prendre en compte et ce terme n’est pas strictement synonyme avec allostérie. Cette nuance, à priori, n’était pas vraiment faite dans les anciens programmes de concours, mais actuellement, si. En tout cas, on ne passe plus trop à côté…
Alors, quand on travaille sur une enzyme avec une structure quaternaire, donc plusieurs monomères liés entre eux par des liaisons de faible énergie, par exemple la glycogène-phosphorylase, il s’effectue en présence de certains composés comme le Pi, une rotation de certains monomères. Cela entraîne la déformation de l’ensemble et chaque monomère présente alors un site catalytique plus ouvert et donc plus accessible aux substrat.
On passe ici d’une forme à faible affinité pour le substrat, enzyme inactive, forme tendue (T), à une forme avec une bonne affinité pour le substrat, forme relâchée (R). Le changement de conformation de T à R est nommée TRANSITION ALLOSTÉRIQUE. Mais c’est aussi ce que l’on appelle un phénomène de COOPÉRATIVITÉ entre les monomères.
Mais, maintenant, ce qui est dit, c’est que c’est seulement de la COOPÉRATIVITÉ, et que l’allostérie ne se limite plus à ces seules structures quaternaires. Une enzyme monomérique également peut être régulée allostériquement, si l’effecteur modifie la forme et le fonctionnement du site actif…
Dans la régulation allostérique, la fonction d’un des sites d’une protéine est modifiée par la liaison d’une molécule régulatrice (ou effecteur positif/négatif) à un autre site (allo signifiant ‘autre’). Du coup, je mets en dessous un premier lien vers un site indiquant également ça:
http://www.chups.jussieu.fr/polys/biochimie/EEbioch/POLY.Chp.6.14.html
puis un article (en français) également sur cette enzyme: lire l’avant dernier paragraphe de la page 1126
http://www.ipubli.inserm.fr/bitstream/handle/10608/2421/1995_8_1121.pdf?sequence=1
Enfin, un exemple d’exercice…
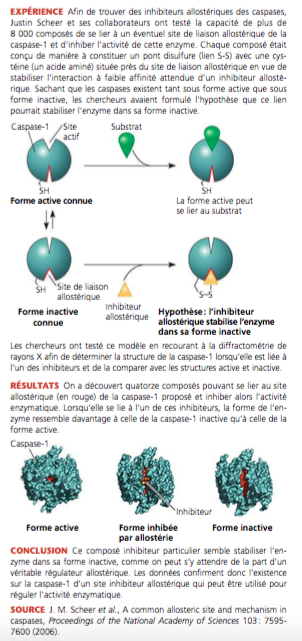
Cette image présente une expérience sur des inhibiteurs allostériques de caspases.
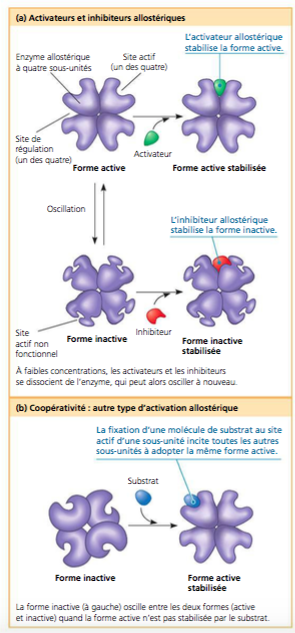
Cette image présente la notion d’activateur et d’inhibiteur allostérique, ainsi que de la coopérativité.
Q2 (de Ysseland): Bonjour, quand vous parlez de la régulation de la PK-L et de la PK-M vous ne précisez pas par quoi elles sont inhibées et activées et vous dites que c’est la même chose. Mais c’est la même chose que quoi ?
R1: Bonjour Ysseland, désolé du retard de réponse: alors cette ‘pyruvate kinase’ L ou M peut être régulé allostériquement, je fais référence au fait que (par rapport à ce que je dis dans la vidéo) : la régulation allostérique de cette enzyme du foie se comporte de la même manière que l’enzyme présente dans le muscle. C’est à dire que l’ATP inhibe allostériquement cette enzyme –> et cela ralentit la glycolyse quand la charge énergétique est haute. Mais aussi, si la vitesse de la glycolyse augmente, le fructose-1,6-biphosphate, active la pyruvate kinase et lui permet de faire face au flux entrant élevé d’intermédiaires.


Merci beaucoup c très bien expliqué et très utile !!
Merci Lou !